(一)GMP与空气净化
药品必须在洁净的环境中进行生产和包装。世界卫生组织早在20世纪60年代初就推荐了“药品生产和质量管理规范”,即所谓的GMP法。目前国际上已有一百多个国家和地区推行GMP,美国、日本、德国等国已作为法律公布执行。我国于1982年制定了“药品生产管理规范”(试行稿),几经修改,于1998年再一次进行了修订,1999年6月由国家药品监督管理局颁布,在全行业推行。“药品生产质量管理规范”也已纳人“药品管理法”。与此同时还编制了“药品生产管理规范”附录对实施细节予以明确规定。
GMP是在药品的制造过程中,对各方面,诸如人员、厂房、设备、原料、工艺、质监、卫生、包装、仓储和销售等严格控制,实行全过程的质量管理,使药品始终保持良好性能。管理措施是针对污染、混药和错配等问题采用相应的设备,保持适当的环境条件,并且根据制造和质量管理方面的各种标准认真检查和记录质量情况。GMP是这一系列质量管理工作的综合实施过程。空调净化设备是实施GMP的重要方面,防止微生物污染或交叉污染仅依靠空调净化系统是不行的,必须注意,当设备条件达到一定水平后,还要通过管理加以实现。
(二)国外GMP的要求
GMP中对空气净化方面的要求是对其室内空气压力、微生物、尘埃和温湿度控制,以达到减少产品污染。包括来自其他产品生产和贮放时产生的微粒细尘污染,减少微生物的传播,确保原材料、半成品和成品的安全贮放。
应尽量减少生产区空气中的有害或无害异物,用空调系统供应足够的洁净空气,以除去可能污染产品的空中微尘。
对现有建筑如果办不到时,要求以足够强度和规格的金属筛网覆盖所有排气口、窗户以及其他开口处,以防昆虫和鼠类进入。门口应设电气扑虫器,用排气通风设施以保证适当空气循环。但在此环境中,不得生产针剂、药膏及眼用制剂。
空调系统应考虑防止新风污物及回风微尘进人工作区,供应足够的风量以驱除工作区的空中异物,各区进气独立管理以适应所需的温湿度。用高效过滤器净化进气,不使细菌和微尘进人等等。
无菌区空气应特别处理,凡空中异物可能污染产品之处,空气应以高效过滤器净化。制剂暴瑶的操作部位,可采用局部层流,垂直层流比水平层流更能减少微尘。应经常控制空气处理效果,在重要部位设尘粒计数仪定时测定,保存记录备查。
无菌灌装区内所有设备都应以层流空气保护,层流罩要有足够的防护层围挡,以防非无菌空气进人无菌区。无菌区需要保持正压,调好温湿度。层流装置应运转正常,每年检查设备一次,每两个月用微粒计数器检查微尘一次。
美国GMP修订本(CGMP)对药厂的通风、空气过滤和冷却提出了如下要求。
(1)提供足够的通风;
(2)提供与药品生产中的制造、工艺、包装和贮存相适应的正压、微生物、灰尘和温湿度控
制设备;
(3)提供同生产区送风相适应的空气过滤系统,包括预过滤和空气粒子过滤器:如生产区用再循环空气时,为控制生产中产生的灰尘,应对空气进行监测。生产中产生污染物的区域,应设有足够的排风系统或其他系统,以保证对污染物的控制;
(4)对青霉素制造和包装应采用完全独立于其他药品生产的空气处理系统。
(三)我国药品生产的GMP
我国“药品生产管理规范”1999年6月由国家药品监督管理局颁布施行,内容同国外的GMP大致相同,但对生产环境空气的控制提出了具体的要求,可归纳为以下几点。
(1) 药品生产洁净室(区)的空气洁净度划分为四个级别,如表7-1所示。
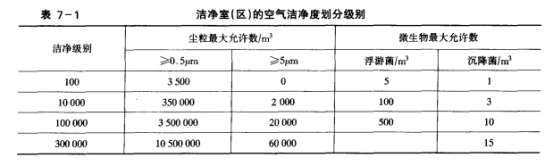
表7一1指出的原料药的结晶、干燥、包装和制剂生产的环境空气洁净度,生产区的划分主
要参考国外生产厂现状并结合我国国情而拟订的。对于某些无菌作业,可根据特殊工艺要求,
在设备上附设局部层流装置或采用超净工作台。
制剂可分为片剂、注射剂以及其他剂型等。口服原料药成品的结晶、干燥、过筛、包装及片
剂生产,可根据工艺要求的温湿度,采用初、中效二级过滤的洁净空调。外用制剂的无菌产品可参考注射剂无菌生产的洁净度要求。
(2)需要的采暖、通风、降温及防尘、防污染、防虫、防鼠等设施。按各区域的要求,进人的空气需经各种不同效率过滤器过滤,室内温湿度应符合工艺要求,并保持一定的压力。
(3)青霉素、激素,抗肿瘤类药物的生产需设有专用的空调和通风系统,要与其他车间严格分开,对于排出上述物质的排气应经净化处理,防止污染大气和药物交叉污染。
“药品生产质量管理规范”明确规定,凡新建、改建、扩建药厂或生产车间必须按GMP要
求进行设计、施工和生产,经省、市卫生行政部门验收合格后,发给“药品生产企业许可证”;原有生产厂也必须达到GMP的认证要求。
本文由重庆净化车间设计|重庆宇邦净化工程编辑。